Beta-Sekretase
| Beta-Sekretase | ||
|---|---|---|
|
Vorhandene Strukturdaten: siehe UniProt P56817 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 456 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer; single pass Typ 1 Membranprotein | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Namen | BACE1, ASP2, BACE, FLJ90568, HSPC104, KIAA1149 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.23.46, Aspartylprotease | |
| MEROPS | A01.004 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 23621 | 23821 |
| Ensembl | ENSG00000186318 | ENSMUSG00000032086 |
| UniProt | P56817 | P56818 |
| Refseq (mRNA) | NM_001207048 | NM_001145947 |
| Refseq (Protein) | NP_001193977 | NP_001139419 |
| Genlocus | Chr 11: 117.29 – 117.32 Mb | Chr 9: 45.84 – 45.86 Mb |
| PubMed-Suche | 23621 | 23821 |
Beta-Sekretase, auch BACE1 (β-site of APP cleaving enzyme) oder Memapsin-2 genannt, ist ein Enzym aus der Familie der Proteasen. Proteasen sind Proteine (Eiweiße), die andere Proteine an bestimmten Stellen schneiden. Dadurch werden Proteine verändert oder abgebaut. Beta-Sekretase ist ein sogenanntes Transmembranprotein, sie ist in der Membran des endoplasmatischen Retikulums (ER) und des Golgi-Apparats lokalisiert. Ihr aktives Zentrum, mit dem sie ihre enzymatische Funktion ausübt, befindet sich in der extramembranären Domäne und enthält zwei Aspartat-Reste. Daher bezeichnet man sie als Aspartatprotease. Die aktive Form der Beta-Sekretase ist vermutlich ein Dimer, d. h., sie besteht aus zwei Untereinheiten. Die Beta-Sekretase ist bei der Bildung der Myelinscheiden von Nervenfasern und der Entstehung der Alzheimer-Krankheit beteiligt.
Rolle bei der Entstehung von Alzheimer
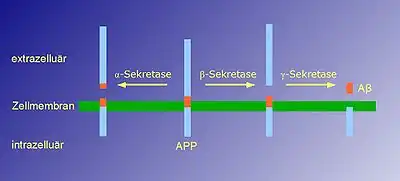
Die Erzeugung des 40 bzw. 42 Aminosäuren langen Beta-Amyloids setzt zwei aufeinanderfolgende enzymatische Spaltungen im Amyloid-Vorläuferprotein APP (amyloid precursor protein) voraus. Die Spaltung durch die Beta-Sekretase im extrazellulären Teil des APP setzt ein lösliches, extrazelluläres Fragment frei. Ihr folgt eine weitere Spaltung des in der Membran verbliebenen APP innerhalb dessen Transmembrandomäne durch die Gamma-Sekretase. Durch diese zweite Spaltung werden die intrazelluläre Domäne von APP und das β-Amyloid-Peptid freigesetzt (siehe Bild).
Die Alpha-Sekretase schneidet APP näher an der Membran als die Beta-Sekretase und entfernt somit einen Teil des β-Amyloid-Peptids. Daher kommt es nur zur Bildung von Amyloidplaques, wenn der erste Spaltungsschritt durch Beta-Sekretase durchgeführt wird, nicht aber bei der Alpha-Sekretase.
Bisher sind keine Mutationen im Gen für die Beta-Sekretase bekannt, die die frühe familiäre Form der Alzheimerkrankheit auslösen – im Gegensatz zu Präsenilin und APP. Dennoch wurde nachgewiesen, dass die Konzentration von Beta-Sekretase bei Alzheimer-Patienten erhöht ist. Da angenommen wird, dass eine Hemmung der Beta-Sekretase zu einer Verlangsamung der Alzheimer-Krankheit führt, wird an entsprechenden Beta-Sekretase-hemmenden Arzneistoffen (Beta-Sekretase-Inhibitoren) geforscht.
In einer Studie an 1.700 isländischen Patienten wurde eine natürliche Mutation im BACE1-Gen entdeckt, die mit der Abwesenheit von Alzheimer und Demenz assoziiert war.[1]
Literatur
- J. Varghese: BACE: Lead Target for Orchestrated Therapy of Alzheimer’s Disease. 1. Auflage. John Wiley & Sons, 2010, ISBN 978-0-470-29342-3
Weblinks
- beta-secretase. PDB Molecule of the month
Einzelnachweise
- ↑ T. Jonsson, J. K. Atwal et al.: Alzheimer disease. Mutation in APP protects against Alzheimer disease. In: Nature Reviews Neurology. Band 8, Nr. 9, 2. August 2012, S. 473, doi:10.1038/nrneurol.2012.158.